|
|
|
|
| 1章 水の構造と性質 | 小林 映章 |
|
1.2 水の性質
1.2.1 水の基本物性
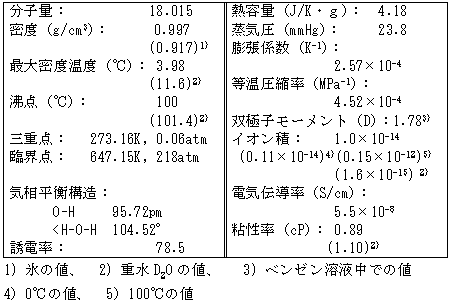
表2に水の基本的な物性値を一括して示しました。
表2 H2Oの物性値
さて、表2はH2Oの基本的な物性を示したもので、いろいろな項目が並んでいますが、何か水について少し詳しく調べてみたいというような場合には役に立つこともあると思います。
(水の酸性・アルカリ性の尺度)
水の良し悪しを云うときに、酸性だとかアルカリ性だとか云うことがあります。この際pH(ピーエイチ)という用語が使われ、pH7の水が中性で良い水だと云われます。このpH7を出すには、表2のイオン積を使うことができます。イオン積というのは、水という溶媒の中でごく僅かの水分子が次のように陽イオンと陰イオンに解離したときの両イオンの積を云います。
2H2O ≠ H3O+ + OH-
水が中性ということは、H3O+の濃度〔H3O+〕とOH-の濃度〔OH-〕が等しいことを意味しています。H3O+の濃度〔H3O+〕を表すのにpHを使います。すなわち、pHは次のように定義されています。
pH ≡ -log〔H3O+〕
表のイオン積を使って容易に0℃、25℃、100℃の水の中性のときのpHを計算することができます。その値はpH7.48、pH7.0、pH6.1のようになります。つまり、pH7が中性というのは25℃のときの話で、温度が変わると同じ値でも内容が変わってしまいます。先の状態図からも分かりますが、水は温度により非常に状態が変わることを理解しておく必要がありそうです。コンクリートを練るのに同じ水を使ったとしても、冬と夏ではひどく違った結果が出る可能性を否定できません。温度の違いは混ぜものが多くなるほど大きくなる可能性があります。 |