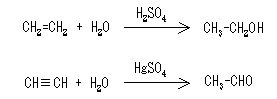|
|
|
|
| 4章 水の係わる反応 | 小林 映章 |
|
水(H2O)は代表的な極性分子で、他の多くの極性分子と水素結合を作りやすく、また水分子相互間での水素結合形成によりいろいろな大きさや形状のクラスターを形作っています。そのため、多くの物質に特異的に付加したり、反応したりする性質があります。例えば、現代生活のかなりの部分はセメントと水が反応して生まれたコンクリートに依存しています。また、最近世界経済の要となってきたITの基となる半導体の製造には水の制御が不可欠です。 本章では水の係わる反応のうち、水和、収着、透過、溶解、および水溶液中の化学反応などについて考えてみます。
4.1 水和 いろいろな化学物質に水が付加することを水和と呼びますが、水が付加する相手物質、付加する状態などは種々様々で、一口に水和と言ってもみな同じではありません。一昔前の化学での「水和」の定義は、 「水溶液中で、溶質分子あるいはイオンがその周囲に数個の水分子を引きつけて結合し、一つの分子集団を作る現象を水和という。水分子と結合が強い場合には水化ということもある。」 というものでした。しかし、現在では水和という言葉は水の係わる反応にもっと広く適用されています。 以下水和について概観します。
(1)水和(hydration)とは
(i) 極性分子に対する溶媒和の一種としての水和 イオンの水和では、電荷−双極子の相互作用、極性分子の水和では、双極子−双極子の相互作用が支配的な働きをしています。 【双極子(dipole):ある系の正、負の電荷を一つの対としてみたもの。】 よく知られているように、水分子(H2O)は水溶液中で解離して水素イオン(H+)と水酸化物イオン(OH-)を作りますが、H+は水和してヒドロニウムイオン(H3O+)になっています。水の中で多くのイオンが安定して存在する、あるいは多くの化合物がよく溶解するということは、別の言葉で云えば、多くのイオンや化合物がよく水和するということを意味しています。 生体高分子ではカルボキシル基やアミノ基などの極性基に水和が起こります。水和によって分子の性質が変わり、例えば生体分子の反応を触媒する酵素の活性はその水和量に依存しています。
(ii) 有機化合物に水分子が付加すること 例えば、次式のように、硫酸や希硫酸の存在下でオレフィンに水が付加してアルコールになる反応や、硫酸水銀(II)の存在下でアセチレンに水が付加してアルデヒドやケトンができる反応を云います。
ホルムアルデヒド、クロラール、シクロプロパノンのようなカルボニル化合物も水和を受けます。水の付加はマルコウニコフ則(Markovnikov law)に従います。 【マルコウニコフ則:
(iii) 無機化合物に水が付加すること 例えば、日常会話で、生石灰(CaO)に水が水和して消石灰(Ca(OH)2)ができると言っています。 CaO + H2O → Ca(OH)2 別の例を挙げますと、大気汚染で問題になる亜硫酸ガス(SO2)は水に溶けると次のように反応します。 SO2 + H2O → H2SO3 亜硫酸(H2SO3)は不安定で遊離の状態では得られていませんが、水に溶けたSO2の大部分は上式のように水和した形で存在します。この水溶液を冷却すると、気体であるSO2の水和物 SO2・6H2O が析出します。つまり亜硫酸ガスを水に溶かすと、2種類の全く違った水和物が得られます。
(セメントの水和) 代表的なセメントである普通ポルトランドセメントの組成は、3CaO・SiO2 52%、2CaO・SiO2 24%、3CaO・Al2O3 9%、4CaO・Al2O3・Fe2O3 9%、その他石膏(CaSO4・2H2O)等となっています。セメントに水を添加すると、主に次のような反応、すなわち、水和反応が先ず起きることが知られています。
2〔3CaO・SiO2〕+ 6H2O → 3CaO・2SiO2・3H2O + 3Ca(OH)2 勿論、実際の反応は複雑で、上記のようなきれいな式で書けるような反応が起きているわけではありませんが、上式はセメントの硬化反応が水和物(コロイド状水和物)を生成して硬化する「水和硬化」反応であることを示しています。 セメントの硬化は、上式に続いて起きる種々の反応により進行します。その中で、上記の3CaO・Al2O3・6H2Oと石膏(CaSO4・2H2O)が反応して生成したエトリンガイト(3CaO・Al2O3・3CaSO4・32H2O)は硬化反応を進行させる主要な反応物です。エトリンガイトには32分子の水が水和していますが、この水は全部同じ状態ではありません。エトリンガイトの化学構造を示性式の形で表しますと、 〔Ca6Al2(OH)12・24H2O〕(SO4)3・2H2O となり、32分子の水のうち、6分子の水は結晶格子内に取り込まれ、26分子の水はH2Oの形、すなわち結晶水の形で水和しています。このうちの幾つかは減圧したり、あるいは100℃以下で弱く加熱すると可逆的に脱水できる水であることが知られています(後藤、大間:セメント化学雑論,P.57,セメント協会(昭60))。 セメントの例をもう一つ示しましょう。 セメントを大気に接した状態で放置すると塊を生じて使えなくなる「風化」が起きます。これは先ずセメント中の遊離の石灰と3CaO・SiO2が空気中の水分と反応してCa(OH)2を生成し、次いでCa(OH)2と CO2が反応してCaCO3を生成します。一方3CaO・Al2O3がCaSO4およびH2Oと反応してエトリンガイトを生成します。CaCO3などは生成過程でセメント粒子の表面を覆い反応性を低下させます。つまりセメントの風化は緩慢な水和反応と炭酸化反応によって起きます。
(iv) 無極性分子の水和 ネオンに相当するような疎水性の粒子を水の中に入れた場合について、粒子に隣接する第1層の水とそれをとりまくバルクの水の状態を調べてみると、水素原子を粒子側に向け、互いに水素結合した籠状の水和殻の存在が認められます。すなわち、粒子近傍の水の方がバルクの水よりも構造性が高いことが分かります。このような水和殻を伴った粒子が会合(疎水性相互作用)する際、分子間に水1分子が介在して安定な水和殻を造るわけです。
(2)水和物 水和の例で挙げた、アルコール、アルデヒド、水酸化カルシウム、亜硫酸などはみな水和物です。また、コンクリートも勿論水和物です。 水溶液から析出する塩類の多くは水を付加して水和物(含水塩)となっています。例えば、コンクリート構造物の表面に水分の蒸散と共に一緒に移動してきた溶存物が白い粉末となって現われることがあります。コンクリート表面の美観をそこなうこの白色粉末はエフロレッセンスと呼ばれていますが、これはNa2SO4・10H2O、CaSO4・2H2O、NaHCO3・Na2CO3・2H2O、MgSO4・7H2Oなどの水和物からなっていることが知られています。 含水塩では、水がカチオン、アニオンと結合する場合それぞれの水を配位水、アニオン水と呼びます。また、水が特定のカチオン、アニオンには結合せず、結晶格子の特定の位置を占める場合や、結晶格子内の任意の位置を占める場合などがあります。この場合には、それぞれの水を格子水、ゼオライト水と呼びます。 その他、広義の水和物として包接化合物(クラスレート)の一つとみなされる気体水和物があります。これは水分子が大きく広がった構造で結晶し、その中にAr、Kr、Xeのような単原子分子や、比較的小さいCl2、SO2、CH3Clなどの分子が穴やトンネルの中に入り込んだような形でおさまったものです。SO2の気体水和物については先にふれました。 【クラスレート(clathrate):
(3)水和異性 例えば塩化クロム六水和物には次の3種類があります。
〔Cr(H2O)6〕Cl3 ……………… [1] [1]式では6個のH2OがCrの周りに配位しています。[2]式では5個のH2OがCrの周りに配位し、1個が結晶水として含まれています。[3]式では4個のH2Oが配位し、2個が結晶水となっています。
(4)水和エネルギー 一般に水和物を形成する際にはエネルギーを放出して安定化します。この水和エネルギーは水和物の形成しやすさの尺度となります。水和エネルギーが大きい程水和物は容易に形成されます。周知のように、セメントが水和すると大きなエネルギーを放出して、すなわち発熱してコンクリートになります。 熱力学的には、発熱反応では熱を取り除いてやる程、吸熱反応では熱を補ってやる程反応は進行します。コンクリート製品を造る際に加熱養生しますが、勿論これは反応速度を高めるためのものであって、熱力学的に矛盾するものではありません。大凡の目安として、温度が10度上昇すると反応速度が約2倍になることを私達は経験的に知っています。 |