|
|
|
|
| 4章 水の係わる反応 | 小林 映章 |
|
4.3 透過 固体の薄層や薄膜の気体(水蒸気を含む)透過(permeation)については古くから研究が行われています。特に高分子薄膜の気体透過性については、実用的に重要なこともあって、多数の研究結果が報告されています。ここではその中で、主題が「水」に関するものですから、水の高分子膜透過性に重点を置いて概観します。
(1) 気体透過理論の単純モデル
図23に示したように、厚さがL、片面がP1、他の面がP2(P1>P2)という圧力の気体に接している高分子薄膜を通して気体分子が透過していくとき、膜面からxのところを単位面積当たり単位時間に拡散していく気体分子の量qは次式で表されます。
上式はFickの第1法則と呼ばれ、Dは拡散係数(diffusion constant)といいます。上式をx = 0からLまで積分しますと、両膜面の気体濃度をC1、C2としたとき、qは
となります。この式から膜を透過する気体の量は膜の厚さに逆比例し、気体の拡散係数および濃度差に比例することが分かります。 膜表面での気体の濃度Ci(i = 1,2)は、
となります。ここでSは溶解度係数(solubility constant)と呼ばれる量です。 したがって、(2)式は
となります。拡散係数Dと溶解度係数Sの積P、すなわち、
は透過係数(permeability constant)と呼ばれ、膜内の気体の透過しやすさを表す基本的な量とされています。(4)式と(5)式から
となり、qは単位面積当たり単位時間における透過量ですから、Pの単位は 〔cm3(STP)・cm/cm2・s・cmHg 〕又は〔g・cm/cm2・s・cmHg〕となります。STPは標準状態を表します。
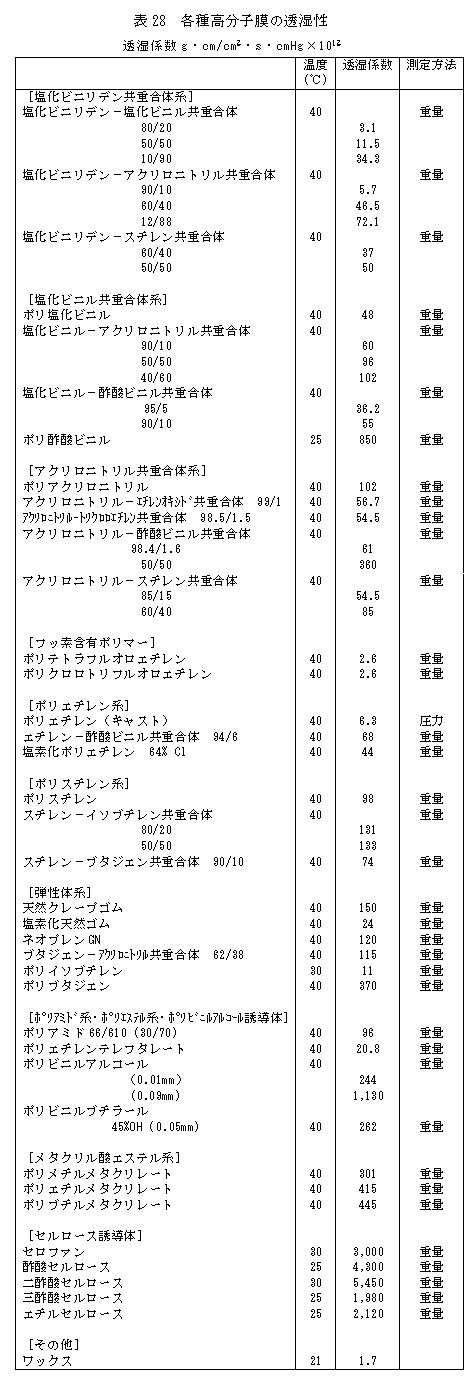
(2) 各種高分子膜の水蒸気透過率
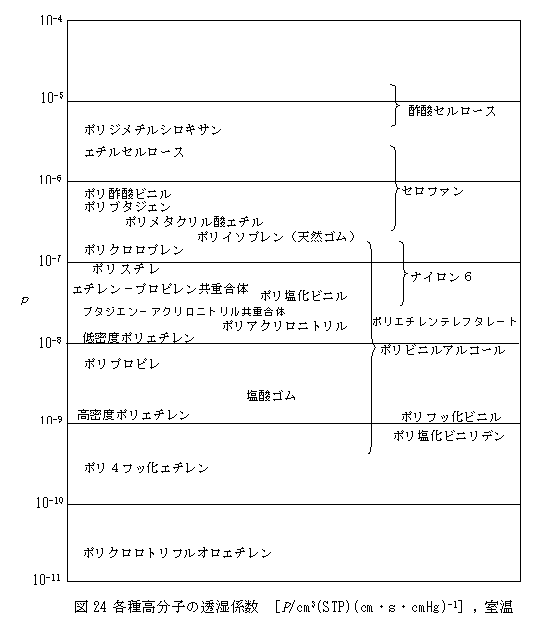
また、図24に別の文献から抜粋した高分子の透湿性を示しました(高分子学会編:高分子と水:P.122,共立出版(1995))。
これらの表又は図により、高分子の種類により水分の透過性がどのように変化するかがほぼ分かると思います。
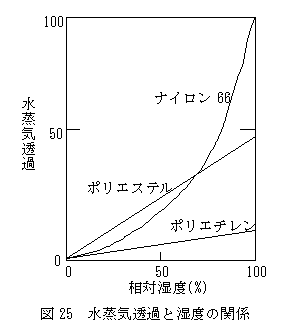
(3) 高分子膜の水蒸気透過の特徴 一方、PH2O/ PN2の関係をみてみますと、N2に対するH2Oの透過率は全く不規則で、水蒸気の透過挙動が極めて複雑であることが分かります。水蒸気のポリエチレンフィルムの透過率を10とすると、水酸基をもつセロファンの透過率は2,000~3,000に達します。また、PH2O/ PN2の比は、ポリエチレンでは約45であるのに対して、セロファンでは1,500を超えます。このように水蒸気の場合は高分子対する親和性、言い換えるならば溶解度係数Sが透過性に大きな影響を与えています。 水蒸気の溶解度係数が高分子膜透過に大きな影響を及ぼしていることは、例えば、親水性の大きいナイロン66と親水性の小さいポリエステルおよびポリエチレンフィルムの水蒸気透過性の湿度依存性にも顕著に現われています(図25参照)。
(4) 浸透と逆浸透
(浸透) 駆動力が温度差の場合を特に熱浸透(thermoosmosis)と云います。また、電位差の場合を特に電気浸透(electroosmosis)と云います。 溶媒が水の場合の浸透は、工業的にも医学分野から見ても特に重要で、例えば腎臓透析は腎疾患の患者に大きな恩恵を与えています。 さて、溶媒分子は通すが、溶質分子は通さない膜(半透膜;semipermeable membrane)で液相IIと純溶媒相Iとを仕切ると、溶媒分子はI→IIヘ半透膜を通って浸透により移行します。IからIIへの溶媒の移動によって、IIの体積が増加し、Iに比してIIの圧力が高くなります。この圧力は溶媒の移動(浸透)に抗する力として働き、浸透の力と釣り合った点で平衡に達します。これを浸透平衡(osmotic equilibrium)の状態と云い、このときのIとIIの圧力差を浸透圧(osmotic pressure)と言います。 浸透圧Πは次式で表されます。
上式により実測のΠからcが決定され、これから溶質の分子量を求めることができます。この方法は高分子の分子量測定に広く利用されています。
(逆浸透) 逆浸透は海水より淡水を得るために利用されていることは周知のとおりです。このために利用される半透膜を狭義の逆浸透膜と呼んでいます。 逆浸透膜の発展はめざましく、50 atm程度の低圧で海水の一段での淡水化が可能になっています。 |