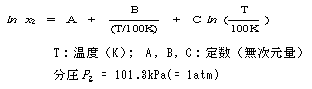|
|
|
|
| 4章 水の係わる反応 | 小林 映章 |
|
4.4 溶解
(1) 溶解とは 物理溶解は溶液と溶媒間に何らの化学的相互作用を有しない系であり、先に述べたヘンリーの法則や正則溶液(特別な分子間相互作用のない非電解質溶液を総称していう)の法則に従います。化学溶解は酸・塩基間の錯体や水素結合の形成、もしくは新たな化合物の生成を生じるもので、吸収とも呼ばれ、特に水溶液において重要です。例えば、塩素・水系、二酸化硫黄・水系など非常に多くの系があります。 物質が溶媒に接したときに溶解するのは、熱力学的には溶質と溶媒が別々に存在するよりも溶液系の全体のギッブスエネルギーが減少し、安定になるからです。
(2) 溶解に関係した用語 吸収係数(absorption coefficient): 気体の液体に対する溶解度を表すのに用います。 ヘンリー係数(Henry coefficient ): ヘンリーの法則によると、理想気体の法則にほぼ従う程度の低い圧力範囲で気体が液体にわずかに溶解する場合、一定温度のもとで気体の圧力pを変えると、気体の溶解度Cはその圧力に比例します。すなわち、 C = kp となります。このkをヘンリー係数と云います。 溶解度積(solubility product; solubility constant): 難溶性の塩の正、負両イオンの積を溶解度積と云い、難溶性塩の溶解度を表すのに用います。溶解度積は一定温度下では一定です。 下部完溶温度(LCST; lower critical solution temperature):低温で完全溶解し、高温で部分溶解する系で、その境界温度を云います。 上部完溶温度(UCST; upper critical solution temperature):低温で2相分離、高温で均一完全溶解する系で、その境界温度を云います。
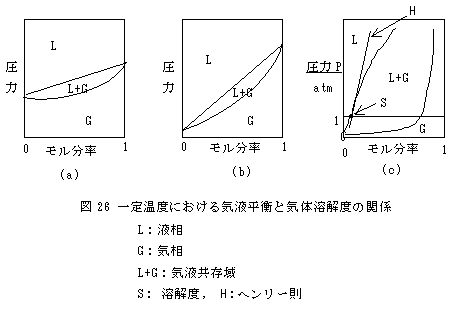
(3) 水に対する気体の溶解
(一定温度のもとでの溶解)
(一定圧力のもとでの溶解)
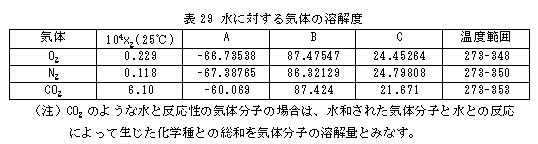
代表的な例として、水中に酸素(O2)、窒素(N2)、二酸化炭素(CO2)が溶解しているときの溶解度(x2)の温度依存性を表29に示しました。
水と反応する気体、例えば、CO2、NH3、SO2などの水への溶解度は大きい値を示しますが、非反応性気体の溶解度は他の多くの有機溶媒に比較しても非常に小さいことが知られています。表29によると、O2、N2の溶解度は、反応性のCO2の溶解度に比して著しく小さいことがよく分かります。 O2の0、25、40、75(℃)における溶解度を上式により計算してみますと、それぞれ x2 = 0.397、0.229、0.187、0.150(×10-4)で、40℃では0℃のときに比較して半分以下に低下します。これをみると高温において例えば魚類が呼吸不全に陥る状況がよく理解できます。
(4) 水に対する液体および固体の溶解
(溶解の温度依存性) 水・2-ブタノール、水・トリエチルアミン、水・アルキルアミン、水・非イオン性界面活性剤、その他多数の水を一方の成分とする混合系では、低温で完全溶解、高温で部分溶解を示します。すなわち、LCSTが存在します。これらの系では混合熱、過剰混合エントロピーは共に負となり、混合により発熱します。このような混合系では、温度が低いほど双極子相互作用が強く働き、水和度も大きくなるためこのような現象を呈します。 また、水・ニコチン、水・ポリエチレングリコール等の系では、UCSTとLCSTの両方が現れます。
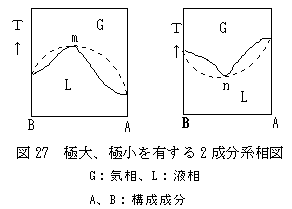
(沸点曲線に極大又は極小を現す溶解) 沸点曲線に極大点が現われる系には、水・硝酸、水・塩酸などがあります。また、極小点が現われるものには水・アルコールなどがあります。これらの混合系を蒸留すると、極大沸点がある場合には、残った液は極大沸点mの組成にに近づいていきます。また、極小沸点がある場合には、残液は純粋成分A、Bいずれかの成分に近づいていきます。極大点m、又は極小点nにおいては、液体と蒸気の組成が一致するため、この液は幾度蒸留しても組成は変わりません。このような組成の混合物を共沸混合物(azeotropic mixture, azeotrope)と云います。
(沸点上昇、凝固点降下) 水に不揮発性溶質が溶けた系では水の沸点が上昇し、凝固点(氷点)が降下します。一般に、溶液の沸点をθb、凝固点をθfとしたとき、希薄溶液で、
溶質が溶媒と反応しない ときには、溶質の性質に関係なく次式の関係が成立します。
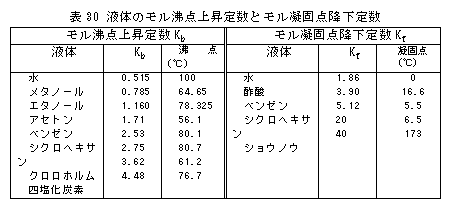
モル沸点上昇およびモル凝固点降下は溶質が1モル溶解しているときの沸点上昇および凝固点降下を表し、溶媒によって決まっています。 水に食塩などの電解質を溶かすと沸点上昇、氷点降下することはよく知られていますが、電解質の場合には上式は当てはまりません。 表30に種々の液体のモル沸点上昇定数とモル凝固点降下定数を示しました。
表30によると、水の沸点上昇定数と凝固点降下定数はいずれも他の液体に比して小さい値を示していますが、これは水分子が水素結合により互いに強く拘束されているためです。
(5) 水に対する電解質の溶解 水に溶解している濃度cの電解質MAのイオン解離(電離)は MA = M+ + A- となり、この電離反応の電離定数(解離定数)Kは電離度をαとしたとき K = cα2/(1-α) となります。Kが有限のとき、無限希釈(c → 0)ではαが1に近づきます。すなわち、完全に電離します。 塩化ナトリウム(NaCl)などの強電解質は α ≒ 1 でほぼ完全に解離していることが知られています。 一方、AgCl、CaCO3などの難溶性の塩は、一定温度で一定濃度を示し、先に述べたように、その塩の正、負両イオンの濃度の積は一定で、これは溶解度積と呼ばれています。表31に溶解度積の例を示しました。
水分子は H2O = H+ + OH- のようにわずかに電離(H+は実際には水和してヒドロニウムイオンH3O+となっている)しており、H+ と OH-の濃度の積は難溶性塩と同様に定義されて、水のイオン積(自己プロトリシス定数(self protolysis constant))と呼ばれています。周知のように水のイオン積は25℃で1.0×10-14(mol・dm3)2で、これに基づいて水溶液の酸性、塩基性が水素イオン濃度(pH)として表現されています。 |